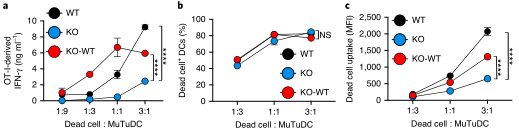
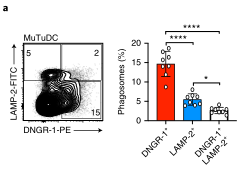
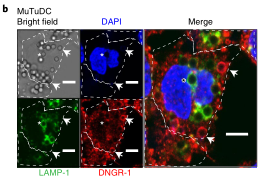
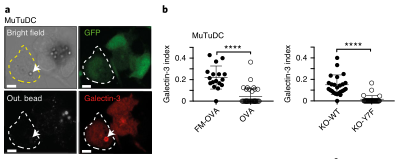
抗原递呈细胞(APCs)在主要组织相容性复合体(MHC)类上呈递外源抗原的能力,一种称为交叉呈递(XP)的过程,对于诱导针对肿瘤和许多病毒的保护性细胞毒性T细胞(CTL)反应至关重要。在多种细胞类型的研究中,出现了两种基本的XP模型。其中一种情况是,抗原加工和MHCi类分子装载完全发生在APCs的吞噬内体区室(“空泡”途径)。在另一种情况下,外源抗原以某种方式进入APC胞质溶胶((P2C)途径),并被蛋白酶体加工成内源性抗原。P2C被认为涉及选择性转运多肽底物穿过吞噬细胞膜的转运蛋白。
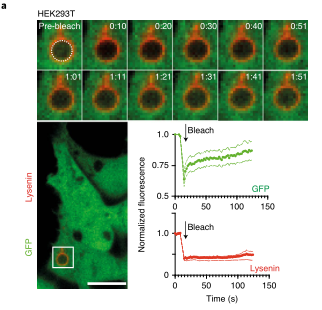
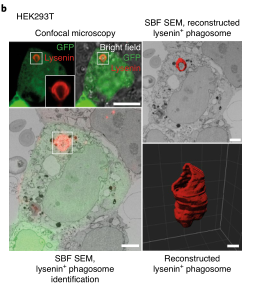
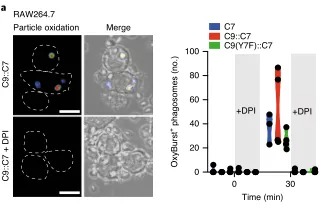
这个假说的一个版本,被称为“消化不良模型”,表明P2C涉及吞噬体破裂和细胞溶质内化货物的大量释放。Caetano等研究团队在《Nature immunology》上发表题为“The receptor DNGR-1 signals for phagosomal rupture to promote cross-presentation of dead-cell-associated antigens”的文章,证明了这个假设。XP途径可能因细胞类型而异。在缺乏1型常规树突状细胞(cdC 1)的Batf3缺陷(Bat F3)小鼠中,针对肿瘤和某些病毒的CD8+ T细胞的启动通常被取消,这表明这些细胞在这些环境中是非冗余交叉呈现的APC。C1细胞具有有利于XP的生物学特性,包括囊泡运输的适应性和相对不能降解吞噬体货物,保存抗原信息。此外,C1细胞可能具有检测潜在抗原货物的受体,并特异性地发出诱导XP的信号。在这方面,小鼠和人类的C1细胞表达高水平的DNGR-1,这是一种C型凝集素受体超家族的ii型跨膜蛋白。cDC1细胞使用DNGR-1检测死亡细胞碎片,通过其胞外结构域与细胞尸体上暴露的F-肌动蛋白-肌球蛋白复合物结合,该复合物已经粘附到cDC1细胞或被cDC1细胞内化。在DNGR-1的短氮端胞内结构域中,有一个半TAM基序,它可以响应DNGR-1配体的接合来募集和激活激酶SYK。值得注意的是,缺乏DNGR-1的小鼠或Syk在cD11c+细胞(包括cDC1)中被切除的小鼠显示死亡细胞相关抗原的XP部分缺陷,这导致针对细胞病变病毒的CD8+ T细胞反应受损。然而,尚不清楚这是否反映了DNGR-1-SYK信号在将死亡细胞货物送入允许XP的特殊内吞室中的作用,还是DNGR-1-SYK信号在导致XP的过程中的更积极作用。在这里,研究人员表明,与配体摄取和吞噬体成熟中的任何作用不同,DNGR-1-SYK信号通过诱导吞噬体膜破裂积极促进配体相关抗原的XP。研究人员的数据表明,存在专门的受体,为P2C选择货物和促进极限编程。结论一:吞噬体DNGR-1参与通过细胞溶质途径选择性调节XP结论二:DNGR-1在降解性差的吞噬体中积累,但对它们的形成是不可缺少的结论四:DNGR-1血红素发出的信号足以在异源细胞中诱导吞噬体破裂结论五:吞噬体破裂是DNGR-1信号介导的XP所必需的结论七:DNGR-1信号依赖吞噬体破裂涉及NADPH氧化酶结论八:没有NOX2时,cDC1对吞噬体的损伤和死亡细胞相关抗原的交叉呈递减少P2C转移的两种机制已被假定:运输和膜破裂或“消化不良”假说。研究人员的数据明显倾向于后者,并表明“消化不良”可能是一个活跃的过程,由此摄入的物质触发C1受体,导致“溃疡”并允许P2C。自噬是否有助于cDC1s的XP仍有待确定,吐出内含物的吞噬体残余物的命运也有待确定。P2C模型的一个变体假设吞噬体与一个内质网高尔基中间隔室融合,提供相关的转运蛋白和肽装载机制。这种融合反过来允许蛋白酶体加工的肽被导入回空泡空间,以局部装载到MHCi分子上(“吞噬体-细胞质-吞噬体”(P2C2P)途径)。显然,在依赖DNGR-1的XP中,P2C2P途径不太可能涉及破裂的吞噬体,但仍可能发生在保持未破裂并与ER衍生膜融合的吞噬体中。SYK可以通过Vav和Rac激活NADPH,所有这些都与髓样细胞对颗粒抗原的XP有关。然而,似乎并不是所有的SYK激活受体都参与这一途径,并导致相同程度的吞噬体损伤。在SYK水平上,每个受体下游的信号发散是如何发生的需要研究,但这意味着DNGR-1主要用于解码内化货物的抗原性。因此,需要从死亡细胞发出额外的信号来激活交叉呈递的cDC1s,并使它们能够在抗病毒或抗肿瘤免疫中启动CD8+ T细胞。激活信号也可以影响XP,了解它们如何与DNGR-1等XP促进受体发出的信号协同作用,将有助于探索并有助于为癌症免疫治疗和疫苗接种准备CD8+ T细胞的策略。原文链接:https:// doi.org/10.1038/ s41590-020-00824-x.